KIÉ A KORONA?
A SARS-CoV-2 tüskefehérje a humán gazdasejtekben aktiválja sejtek közötti jelátvitelt: A COVID-19 vakcinák lehetséges hatásaival kapcsolatos megállapítások
Megjelent online 2021 Jan 11. doi: 10.3390/vaccines9010036. PMCID: PMC7827936 PMID: 33440640
Yuichiro J. Suzuki1,* és Sergiy G. Gychka2
Absztrakt
A világot a SARS-CoV-2 által okozott COVID-19 világjárvány sújtja. A SARS-CoV-2 a tüskefehérjével jut be a gazdasejtekbe. Jelenleg olyan vakcinákat fejlesztenek, amelyek a spike fehérjét juttatják be a szervezetünkbe, hogy vírusneutralizáló antitesteket váltsanak ki. Ebben a cikkben megjegyezzük, hogy az emberi gazdasejtek érzékenyen reagálnak a spike fehérjére, hogy előidézzék a sejtes jelátvitelt. Ezért fontos tisztában lenni azzal, hogy az új COVID-19 vakcinák által termelt tüskefehérje is hatással lehet a gazdasejtekre. Gondosan figyelemmel kell kísérnünk ezeknek a vakcináknak a hosszú távú következményeit, különösen akkor, ha egyébként egészséges egyéneknek adják be őket. A SARS-CoV-2 spike fehérje emberi sejtekre és megfelelő kísérleti állatmodellekre gyakorolt hatásainak további vizsgálata indokolt.
Laboratóriumunk csak a SARS-CoV-2 tüskefehérje hatásait vizsgálta a tüdő érrendszeri sejtjeiben és a PAH kialakulásában szerepet játszó sejtekben. Ez a tüskefehérje azonban hatással lehet a szisztémás és a koszorúér sejtjeire is, kiváltva más szív- és érrendszeri betegségeket, mint például a koszorúér-betegséget, a szisztémás magas vérnyomást és a stroke-ot. A szív- és érrendszeri sejteken kívül más, ACE2-t expresszáló sejtekre is hatással lehet a SARS-CoV-2 tüskefehérje, ami kedvezőtlen kórfolyamatokat idézhet elő. Ezért fontos mérlegelni annak lehetőségét, hogy az új COVID-19 vakcinák által termelt SARS-CoV-2 tüskefehérje olyan sejtszignalizációs eseményeket is kivált, amelyek bizonyos egyéneknél elősegítik a PAH, más kardiovaszkuláris szövődmények és/vagy más szövetek/szervek szövődményeinek kialakulását.”
„Összefoglalva, a SARS-CoV-2 tüskésfehérje-alapú COVID-19 vakcina kifejlesztésének közelmúltbeli előrehaladása izgalmas, és felvillantotta a jelenlegi világjárvány megszüntetésének lehetőségeit. Ezek a vakcinák előnyösek lehetnek az alapbetegségben szenvedő idős emberek számára, ha nem jelentkeznek akut mellékhatások. Ugyanakkor gondosan mérlegelnünk kell hosszú távú következményeiket, különösen akkor, ha egyébként egészséges egyéneknek, valamint fiatal felnőtteknek és gyermekeknek adják be őket. A SARS-CoV-2 vírussal fertőzött egyének, valamint a tüskefehérje-alapú vakcinákat kapó személyekről rendelkezésre álló adatok értékelése mellett indokolt a SARS-CoV-2 tüskefehérje hatásának további vizsgálata emberi sejtekben és megfelelő állatmodellekben.”
Kulcsszavak: sejtjelátvitel, coronavírus, COVID-19, SARS-CoV-2, spike protein, vakcina, vakcina
1. Bevezetés
A világot a 2019-es koronavírus-betegség (COVID-19) világjárvány sújtja, amelyet a súlyos akut légzőszervi szindrómás koronavírus 2 (SARS-CoV-2), egy pozitiv szenzoros, egyszálú RNS-vírus okoz [1,2]. 2020. december végéig több mint 80 millió ember fertőződött meg a SARS-CoV-2 vírussal, ami világszerte 1,8 millió ember halálát okozta. A SARS-CoV-2 a vírus membránfúziós fehérjéjét, az úgynevezett tüskefehérjét használja arra, hogy "receptorként" az angiotenzin konvertáló enzim 2-höz (ACE2) kötődve bejusson az emberi gazdasejtekbe [3,4], súlyos tüdőgyulladást és akut légzési distressz szindrómát (ARDS) okozva [5]. A szív- és érrendszeri betegségben szenvedő idős betegek különösen hajlamosak a súlyos COVID-19 állapotok kialakulására, amelyek egyes esetekben halálhoz vezetnek, míg a fiatal és egészséges emberek többnyire ellenállóak a súlyos tünetek kialakulásával szemben [1,6,7]. Mivel a COVID-19 továbbra is súlyos egészségügyi, gazdasági és szociológiai problémákat okoz, a világ a hatékony vakcinák általános bevezetésére vár, amelyek véget vethetnek ennek a világjárványnak.
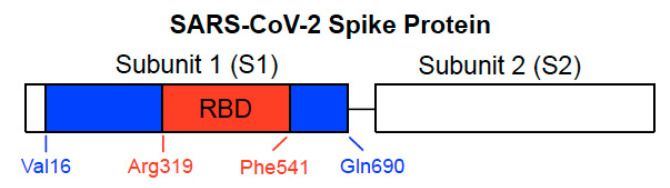
A SARS-CoV-2 tüskefehérje, egy I. osztályú vírusfúziós fehérje, kritikus fontosságú a vírus és a gazdasejt felszíni receptora közötti kölcsönhatások elindításában, megkönnyítve a vírus bejutását a gazdasejtbe azáltal, hogy segíti a vírus és a gazdasejt membránjának összeolvadását. Ez a fehérje két alegységből áll: Az 1. alegységből (S1), amely az ACE2 receptor-kötő domént (RBD) tartalmazza, és a 2. alegységből (S2), amely a fúziós folyamatban játszik szerepet [3,4] (1. ábra). A SARS-CoV-2 tüskefehérje a COVID-19 vakcinák kifejlesztésének fő célpontja.
1. ábra A SARS-CoV-2 tüskefehérje szerkezete. A tüskefehérje az 1. alegységből (S1) és a 2. alegységből (S2) áll. Az S1 alegység tartalmazza a receptor-kötő domént (RBD), amely a gazdasejt membránjának ACE2-hez kötődik. Az S2 alegység felelős a fúzióért. A 3. és 5. szakaszban leírt korábbi vizsgálatunkban a kék és piros régiókkal ábrázolt teljes hosszúságú S1 (Val16-Gln690) és a SARS-CoV-2 tüskefehérjéből (GenBank Accession Number: QHD43416.1) a csak RBD-t tartalmazó fehérjét (Arg319-Phe541) használtuk, amelyet piros színnel ábrázoltunk.
2. Tüskefehérje-alapú COVID-19 vakcinák kifejlesztése
A COVID-19 elleni vakcinák és terápiás készítmények figyelemre méltóan gyors fejlesztése 2020-ban a kormányok és a magánszektor közötti hatékony együttműködésnek köszönhető. 2020. november 9-én a Pfizer és a BioNTech bejelentette, hogy mRNS-alapú vakcinajelöltjük, a BNT162b2 több mint 90%-ban hatékony a COVID-19 ellen [8]. Ez örvendetes hír volt, mivel megmutatta, hogy hamarosan hatékony vakcinák válhatnak elérhetővé. A BNT162b2 a SARS-CoV-2 tüskefehérjét kódolja, hogy vírusneutralizáló antitesteket váltson ki [9,10]. Pontosabban, a SARS-CoV-2 teljes hosszúságú tüskefehérjét kódolja, az S2 alegységben két aminosav prolinná mutálódásával a prefuzionális transzformáció fenntartása érdekében, míg testvérvakcinája, a BNT162b1 (szintén a Pfizer/BioNTech-től) csak a SARS-CoV-2 tüskefehérjének RBD-jét kódolja, amelyet egy T4 fibritin foldon domén hozzáadásával trimerizáltak [9,10,11]. Klinikai vizsgálatok kimutatták, hogy sem a BNT162b1 [11], sem a BNT162b12 [9,10] nem mutat súlyos rövid távú mellékhatásokat. 2020. december 10-én közzétették a BNT162b nagy klinikai vizsgálatának eredményeit, amelyek szerint ez a vakcina 95%-os védettséget nyújtott a 16 éves vagy annál idősebb személyek körében [12]. Ezeknek a vakcináknak a hosszú távú hatásai azonban ismeretlenek.
Egy másik ígéretes vakcina, a Moderna által gyártott mRNS-1273 szintén egy RNS-vakcina, amely a teljes hosszúságú SARS-CoV-2 spike fehérjét kódolja [13]. A vírusvektor-alapú vakcinák, mint például az AstraZeneca által gyártott AZD1222, amely egy nem replikálódó csimpánz adenovírus vektort használ [14], a Johnson & Johnson által gyártott Ad26.COV2.S, egy nem replikálódó adenovírus 26 alapú rendszer [15], és a Gamaleya Epidemiológiai és Mikrobiológiai Kutatóintézet által gyártott Gam-COVID-Vac (Sputnik V) [16], mind a SARS-CoV-2 spike fehérjét expresszálják. Az NVX-CoV2373 (Novavax), egy rekombináns fehérje alapú vakcina [17] szintén a teljes hosszúságú SARS-CoV-2 spike fehérjét tartalmazza. Ezek a vakcinák, valamint számos más, fejlesztés alatt álló vakcina [18,19,20] a SARS-CoV-2 spike fehérjét juttatják a szervezetünkbe, így serkentik az antitestek termelődését és a SARS-CoV-2 elleni immunitást.
3. A SARS-CoV-2 tüskefehérje kiváltja a sejtek közötti jelátvitelt az emberi sejtekben
Megállapították, hogy a tenyésztett primer humán tüdőartéria simaizomsejtek (SMC-k) vagy humán tüdőartéria endotélsejtek rekombináns SARS-CoV-2 tüskefehérje S1 alegységgel történő kezelése elegendő a sejtek jelátvitelének elősegítéséhez a többi víruskomponens nélkül [21]. Továbbá a COVID-19-ben elhunyt betegek postmortem tüdőszöveteinek elemzésével megállapítottuk, hogy ezeknél a betegeknél a tüdő érfalának megvastagodása, a pulmonális artériás hipertónia (PAH) egyik jellemzője volt megfigyelhető [21]. Ezen eredmények alapján azt feltételeztük, hogy a SARS-CoV-2 spike fehérje (a többi víruskomponens nélkül) olyan jelátviteli folyamatokat indít el a sejtekben, amelyek elősegíthetik a tüdő érrendszeri átépülését és a PAH-t, valamint esetleg más kardiovaszkuláris szövődményeket [21,22].
Sejttenyésztési kísérleteinkben két rekombináns SARS-CoV-2 tüskefehérjét vizsgáltunk, amelyek mindegyike tartalmazza az RBD-t [21]. A teljes hosszúságú S1 alegység fehérje az S1 alegység nagy részét tartalmazza (Val16-Gln690), míg az RBD S1 alegység fehérje csak az RBD régiót (Arg319-Phe541), ahogy az 1. ábrán látható. A tenyésztett primer humán tüdőartéria SMC-ket és humán tüdőartéria endotélsejteket 10 percig kezeltük ezekkel a fehérjékkel. Foszfo-specifikus MEK antitestet használva azt találtuk, hogy a SARS-CoV-2 teljes hosszúságú S1 alegységének rekombinánsa önmagában már 130 pM koncentrációban is aktiválta a MEK-et, az extracelluláris jel-szabályozott kináz (ERK) aktivátorát és a sejtnövekedés jól ismert jelátviteli mechanizmusát [23]. Ezzel szemben a sejtek jelátvitelének ilyen aktiválása a tüskefehérje által nem történt meg patkány tüdőartéria SMC-kben [21].
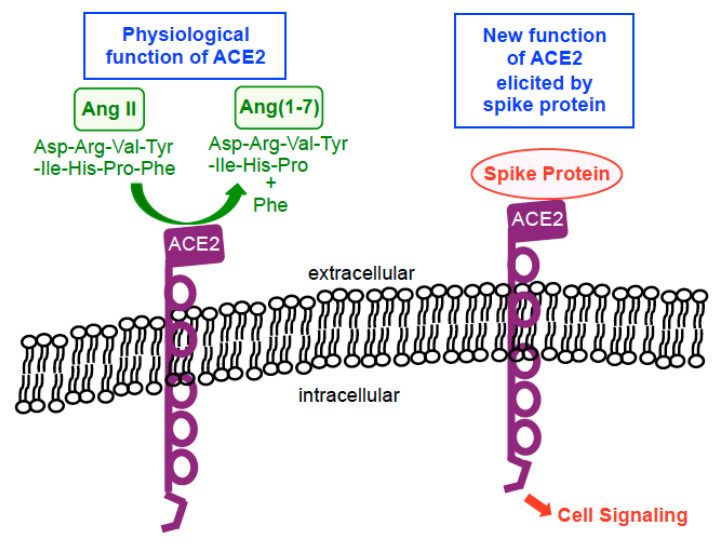
Míg az ACE2 ma már jól ismert olyan " receptor", amelyhez a SARS-CoV-2 tüskefehérje kötődik a humán gazdasejteken a membránfúzió elősegítése és a vírus bejutása érdekében, az ACE2 szokásos fiziológiai funkciója nem az, hogy membránreceptorként szolgáljon intracelluláris jelek továbbítására. Az ACE2 egy I. típusú integrális membránfehérje, amely karboxipeptidázként működik, az angiotenzin II-t angiotenzinné (1-7) hasítja és szabályozza a vérnyomást [24,25] (2. ábra). Tíz évvel ezelőtt azonban Chen és munkatársai [26] arról az érdekes eredményről számoltak be, amely szerint az ACE2 membránreceptorként működik a sejtek jelátvitelében a SARS-CoV (ma már SARS-CoV-1 néven is ismert, a 2002-2004-es SARS-járványt okozó vírus) tüskefehérjéjére adott válaszként a humán tüdő alveoláris epithel sejtvonalában, az A549-ben. A SARS-CoV-1 tüskefehérje 76-78%-ban azonos a SARS-CoV-2 fehérjéjével [27]. Vizsgálatukban kimutatták, hogy a teljes hosszúságú spike fehérje ACE2-hez való kötődése kiváltotta az aktivátor protein-1 (AP-1) transzkripciós faktor kazeinkináz II-függő aktiválódását és az azt követő géntranszkripciós eseményeket [26]. A SARS-CoV-1-re vonatkozó eredményük [26] és a SARS-CoV-2-re vonatkozó eredményünk [21] azt jelzi, hogy a tüskefehérje figyelemre méltó módon funkcionálisan átalakítja az ACE2-t (amely normális esetben egy peptidáz enzim) egy membránreceptorrá a sejtek jelátviteléhez, amely a tüskefehérjét használja ligandumként az aktiválásához (2. ábra).
2. ábra Az ACE2 biológiai funkciói. Fiziológiás helyzetekben az ACE2 karboxipeptidáz enzimként működik, amely katalizálja az angiotenzin II (Ang II) hidrolízisét Ang(1-7)-vé egy fenilalanin (Phe) leválasztásával. A tüskefehérje jelenlétében ez az enzim membránreceptorrá válik a sejtek jelátviteléhez, amely a tüskefehérjét használja ligandumként az aktiválásához.
Kuba és munkatársai [28] kimutatták, hogy az egerek rekombináns SARS-CoV-1 tüskefehérjével történő injektálása csökkentette az ACE2 expresszióját és súlyosbította a savak által kiváltott tüdőkárosodást. A sav indukálta tüdőkárosodásban szenvedő egerekben a rekombináns SARS-CoV-1 tüskefehérje drámaian megnövelte az angiotenzin II-t, és az angiotenzinreceptor-gátló lozartán mérsékelte a tüskefehérje által kiváltott tüdőkárosodás fokozódását [28]. Ezek az in vivo vizsgálatok tehát azt mutatták, hogy a SARS-CoV-1 tüskefehérje (a vírus többi része nélkül) csökkenti az ACE2 expresszióját, növeli az angiotenzin II szintjét, és súlyosbítja a tüdőkárosodást.
A SARS-CoV-2 tüskefehérjéről a többi víruskomponens nélkül Patra és munkatársai [29] szintén kimutatták, hogy aktiválja a sejtek jelátvitelét. A szerzők arról számoltak be, hogy a teljes hosszúságú SARS-CoV-2 tüskefehérje, amelyet tranziens transzfekcióval expresszáltak akár az A549-es humán tüdő alveoláris epitél sejtvonalban, akár a Huh7.5 humán máj epitél sejtvonalban, aktiválta az NF-κB és az AP-1 transzkripciós faktorokat, valamint a p38 és ERK mitogén-aktivált protein kinázokat, felszabadítva az interleukin-6-ot. Ezt a sejtszignál-kaszkádot a SARS-CoV-2 tüskefehérje az ACE2 fehérje expressziójának downregulációjával, majd az angiotenzin II 1-es típusú receptor aktiválásával váltotta ki [29]. Ezek a tranziens transzfekcióval végzett kísérletek a tüskefehérje intracelluláris hatásait tükrözhetik, amelyeket az RNS- és vírusvektor-alapú vakcinák válthatnak ki.
Ezek az eredmények együttesen azt az elképzelést támasztják alá, hogy az emberi sejtekre az extracelluláris és/vagy intracelluláris tüskefehérjék azáltal, hogy aktiválják a sejtszignál-transzdukciót, igen érzékenyen hatnak.
4. Pulmonális hipertónia - érthetőbben ezen a linken:
A PAH súlyos, gyógyíthatatlan betegség, amely bármely életkorú férfiakat és nőket, köztük gyermekeket is érinthet. A PAH-ban a megnövekedett pulmonális érellenállás jobbszívfél-elégtelenséghez, majd halálhoz vezet. A PAH-val diagnosztizált betegek kezeletlenül átlagosan csak 2-3 évet élnek a diagnózis felállításától számítva [30,31]. Még a jelenleg rendelkezésre álló terápiák mellett is csupán a PAH-betegek 60-70%-a éli túl a három évet [32,33,34,35]. A PAH-t nehéz felismerni, mert tünetei (pl. légszomj, fáradtság és szédülés) hasonlóak más gyakori, nem életveszélyes állapotok tüneteihez, és a PAH hivatalos diagnózisát invazív jobb szívkatéterezéssel kell felállítani [36]. Az endotheldiszfunkció közös jellemzője a PAH-ban és a COVID-19-ben szenvedő betegeknek [37,38].
A PAH " betegség "kitörése" bizonyos gyógyszereknek vagy toxinoknak való kitettséggel összefüggésben fordult elő [39]. A PAH egyik legnagyobb előfordulása 1965-ben történt, és az aminorexszel, egy testsúlycsökkentést serkentő gyógyszerrel hozható összefüggésbe [39,40]. A gyógyszert szedő emberek körülbelül 0,2%-ánál alakult ki PAH [40]. Az aminorex bevezetése után két évvel egy járványt figyeltek meg, és a betegek fele 10 évvel a járvány után meghalt [39].
A COVID-19 betegek és az ARDS-ben elhunyt H1N1 influenza-fertőzött betegek pulmonális ereit vizsgáltuk [21]. A postmortem COVID-19-es betegek tüdejének tüdőartériái konzisztensen az érfal megvastagodásának szövettani jellemzőit mutatták, ami főként a tunica media hipertrófiájának volt köszönhető. A részletes patológiai elemzés kimutatta, hogy az erek és a környező tüdőparenchima közötti határok elvesztették tisztaságukat, az artériák középső bélésének SMC-i megnagyobbodtak, az SMC-k magjai megduzzadtak, és az SMC-k citoplazmájában vakuolumok keletkeztek [21]. A morfometriai elemzés megállapította, hogy a tüdőérfal vastagságának medián értékei a COVID-19-es betegeknél 15,4 μm, az influenzás betegeknél pedig 6,7 μm voltak, és ezek az értékek szignifikánsan különböztek egymástól [21]. A COVID-19 betegeknél a tüdő érfalának megvastagodását a mellkas komputertomográfiás vizsgálatán is megfigyelték [41,42]. Így ezek az eredmények együttesen azt jelezték, hogy a COVID-19 összefügg a tüdő érfalának megvastagodásával. Vizsgálatok indokoltak arra vonatkozóan, hogy ez a tüdő érfal megvastagodás összefüggésben van-e a klinikailag jelentős PAH-val, és hogy a tüskefehérje milyen szerepet játszik a PAH patogenezisében.
5. A csak RBD-t tartalmazó SARS-CoV-2 tüskefehérje nem vált ki sejtszignálást humán sejtekben.
Szemben a teljes hosszúságú spike proteinnel [26,29] vagy a teljes hosszúságú SARS-CoV-2 spike protein S1 alegységgel [21], azt találtuk, hogy a csak RBD-t tartalmazó fehérje (1. ábra) nem vált ki sejtszignált. A MEK aktivációt monitorozó Western blotting eredményeink azt mutatták, hogy a foszforilált MEK és a MEK fehérje arányának átlagos ± SEM értékei 0,05 ± 0,003 (kezeletlen), 1,9 ± 0,07 (a teljes hosszúságú S1 fehérjével kezelve) és 0,05 ± 0,05 ± 0,003 (a teljes hosszúságú S1 fehérjével kezelve) voltak. 003 (csak RBD-tartalmú fehérjével kezelve) humán tüdőartéria SMC-k esetében; és 0,09 ± 0,006 (kezeletlen), 0,90 ± 0,06 (teljes hosszúságú S1 fehérjével kezelve) és 0,10 ± 0,003 (csak RBD-tartalmú fehérjével kezelve) humán tüdőartéria endotélsejtek esetében [21].
A teljes hosszúságú S1 és a csak RBD-t tartalmazó fehérjék eltérő hatásai fontosak lehetnek, figyelembe véve, hogy a BNT162b2 és számos más COVID-19 vakcina a teljes hosszúságú tüskefehérjét expresszálja, míg a BNT162b1 vakcina csak az RBD régiót kódolja [9,10,11,12,13,14,15,16,17,18,19,20]. Néhány más RBD-alapú COVID-19 vakcina is fejlesztés alatt áll [43]. Lehetséges, hogy az RBD-alapú vakcinák kevésbé immunogének, de nem befolyásolják a gazdasejteket. Így kevésbé lehetnek kockázatosak, figyelembe véve a lehetséges hosszú távú káros hatásokat. A SARS-CoV-1 tüskefehérje fentebb leírt in vivo vizsgálatában [28] azonban egy olyan delióziós mutáns, amely csak az RBD-t tartalmazta, a teljes hosszúságú tüskefehérjéhez hasonlóan szintén fokozta a sav indukálta tüdőelégtelenséget. Ezért további kutatásokra van szükség a teljes hosszúságú tüskefehérje és a csak RBD-t tartalmazó fehérjének a különböző biológiai folyamatokban kifejtett hatásainak megértéséhez.
6. Vizsgálandó kérdések
Általában úgy gondolják, hogy a vírusmembrán fúziós fehérjék egyetlen funkciója, hogy lehetővé tegyék a vírusok számára a gazdasejtekhez való kötődést a vírus sejtekbe való bejutása céljából, hogy a genetikai anyagok felszabadulhassanak, és a vírus replikáció és amplifikáció megtörténhessen. A legújabb megfigyelések azonban arra utalnak, hogy a SARS-CoV-2 tüskefehérje önmagában is képes olyan sejtszignálokat kiváltani, amelyek különböző biológiai folyamatokhoz vezethetnek. Ésszerűen feltételezhető, hogy ezek az események bizonyos esetekben bizonyos betegségek patogenezisét eredményezik.
Laboratóriumunk csak a SARS-CoV-2 tüskefehérje hatásait vizsgálta a tüdő érrendszeri sejtjeiben és a PAH kialakulásában szerepet játszó sejtekben. Ez a fehérje azonban hatással lehet a szisztémás és a koszorúér sejtjeire is, kiváltva más szív- és érrendszeri betegségeket, mint például a koszorúér-betegséget, a szisztémás magas vérnyomást és a stroke-ot. A szív- és érrendszeri sejteken kívül más, ACE2-t expresszáló sejtekre is hatással lehet a SARS-CoV-2 tüskefehérje, ami kedvezőtlen kórfolyamatokat idézhet elő. Ezért fontos mérlegelni annak lehetőségét, hogy az új COVID-19 vakcinák által termelt SARS-CoV-2 tüskefehérje olyan sejtszignalizációs eseményeket is kivált, amelyek bizonyos egyéneknél elősegítik a PAH, más kardiovaszkuláris szövődmények és/vagy más szövetek/szervek szövődményeinek kialakulását (3. ábra). Gondosan figyelemmel kell kísérnünk a tüskefehérjét az emberi szervezetbe juttató COVID-19 vakcinák hosszú távú következményeit. Továbbá, bár a tüskefehérje-alapú COVID-19 vakcinák lehetséges hosszú távú következményeire vonatkozó humán adatok egyhamar nem állnak rendelkezésre, elengedhetetlen, hogy a lehető leghamarabb megfelelő kísérleti állatmodelleket alkalmazzunk annak biztosítására, hogy a SARS-CoV-2 tüskefehérje ne idézze elő a PAH vagy bármely más krónikus kóros állapot patogenezisének jeleit.
A SARS-CoV-2 tüskefehérje lehetséges hatásai. Az intakt vírus SARS-CoV-2 spike fehérjéje a gazdasejtek ACE2-jét célozza meg a membránfúzió és a vírus bejutásának elősegítése érdekében. A SARS-CoV-2 spike fehérje emberi sejtekben is kiváltja a sejtek jelátvitelét [21,29]. A COVID-19 vakcinák a tüskefehérjét juttatják be az emberi szervezetbe. A COVID-19 vakcinák által termelt tüskefehérje a vírus behatolását elnyomó immunválasz kiváltásán túlmenően hatással lehet a gazdasejtekre is, ami esetleg nemkívánatos folyamatokat válthat ki. További, ezt a lehetőséget vizsgáló vizsgálatok szükségesek.
7. Következtetések
Összefoglalva, a SARS-CoV-2 tüskésfehérje-alapú COVID-19 vakcina kifejlesztésének közelmúltbeli előrehaladása izgalmas, és felvillantotta a jelenlegi világjárvány megszüntetésének lehetőségeit. Ezek a vakcinák előnyösek lehetnek az alapbetegségben szenvedő idős emberek számára, ha nem jelentkeznek akut mellékhatások. Ugyanakkor gondosan mérlegelnünk kell hosszú távú következményeiket, különösen akkor, ha egyébként egészséges egyéneknek, valamint fiatal felnőtteknek és gyermekeknek adják be őket. A SARS-CoV-2 vírussal fertőzött egyének, valamint a tüskefehérje-alapú vakcinákat kapó személyekről rendelkezésre álló adatok értékelése mellett indokolt a SARS-CoV-2 tüskefehérje hatásának további vizsgálata emberi sejtekben és megfelelő állatmodellekben.
![A SARS-CoV-2 tüskefehérje lehetséges hatásai. Az intakt vírus SARS-CoV-2 spike fehérjéje a gazdasejtek ACE2-jét célozza meg a membránfúzió és a vírus bejutásának elősegítése érdekében. A SARS-CoV-2 spike fehérje emberi sejtekben is kiváltja a sejtek jelátvitelét [21,29]. A COVID-19 vakcinák a tüskefehérjét juttatják be az emberi szervezetbe. A COVID-19 vakcinák által termelt tüskefehérje a vírus behatolását elnyomó immunválasz kiváltásán túlmenően hatással lehet a gazdasejtekre is, ami esetleg nemkívánatos folyamatokat válthat ki. További, ezt a lehetőséget vizsgáló vizsgálatok szükségesek. A SARS-CoV-2 tüskefehérje lehetséges hatásai. Az intakt vírus SARS-CoV-2 spike fehérjéje a gazdasejtek ACE2-jét célozza meg a membránfúzió és a vírus bejutásának elősegítése érdekében. A SARS-CoV-2 spike fehérje emberi sejtekben is kiváltja a sejtek jelátvitelét [21,29]. A COVID-19 vakcinák a tüskefehérjét juttatják be az emberi szervezetbe. A COVID-19 vakcinák által termelt tüskefehérje a vírus behatolását elnyomó immunválasz kiváltásán túlmenően hatással lehet a gazdasejtekre is, ami esetleg nemkívánatos folyamatokat válthat ki. További, ezt a lehetőséget vizsgáló vizsgálatok szükségesek.](/____impro/1/onewebmedia/i284571214520270963.jpg?etag=%221b68c-5db44839af051%22&sourceContentType=&ignoreAspectRatio&resize=671%2B438&extract=0%2B0%2B671%2B437)