KIÉ A KORONA?
A SARS-CoV-2 tüske egyedi inzertjének szuperantigén jellege, amelyhez ferde TCR-repertoár társul a hiperinflammációban szenvedő betegeknél
Jelentősége
A toxikus sokk szindrómára (TSS) emlékeztető hiperinflammatorikus szindróma figyelhető meg a súlyos COVID-19 betegeknél, beleértve a multiszisztémás gyulladásos szindrómában (MIS-C) szenvedő gyermekeket is. A TSS-t jellemzően az adaptív immunrendszer túlzott aktiválódását serkentő patogén szuperantigének okozzák. Kimutattuk, hogy a SARS-CoV-2 tüskefehérje olyan szekvencia- és szerkezeti motívumokat tartalmaz, amelyek nagymértékben hasonlítanak egy bakteriális szuperantigénhez, és közvetlenül kötődhetnek a T-sejt receptorokhoz. Továbbá beszámolunk egy eltorzult T-sejt-receptor-repertoárról COVID-19-es betegeknél, akiknél súlyos hiperinflammáció lépett fel, ami alátámasztja az ilyen szuperantigén hatást. Figyelemre méltó, hogy a szuperantigén-szerű motívum nincs jelen a SARS-család más koronavírusaiban, ami magyarázatot adhat a SARS-CoV-2 egyedülálló képességére, hogy mind a MIS-C, mind a felnőtt COVID-19-ben megfigyelt citokinvihart okozza.
A COVID-19-hez társuló többszervi gyulladásos szindróma gyermekeknél (MIS-C) egy újonnan felismert állapot a közelmúltban a coronavírus 2 (SARS-CoV-2) fertőzésben szenvedő gyermekeknél. Ezek a nagyfokú gyulladásos állapotú gyermekek és felnőtt betegek olyan tünetegyüttest mutatnak, amely erősen hasonlít a toxikus sokk szindrómára, a citotoxikus adaptív immunválasz eszkalációjára, amelyet a patogén szuperantigének T-sejt receptorokhoz (TCR) és/vagy a II. osztályú fő hisztokompatibilitási komplex (MHCII) molekulákhoz való kötődése vált ki. Itt, szerkezetalapú számítási modellek segítségével kimutattuk, hogy a SARS-CoV-2 spike (S) glikoprotein nagy affinitású motívumot mutat a TCR-ek kötésére, és képes hármas komplexet alkotni az MHCII-vel. Az S-en található kötő epitóp egy olyan szekvencia-motívumot tartalmaz, amely csak a SARS-CoV-2-re jellemző (más SARS-szel rokon coronavírusokban nincs jelen), és amely mind szekvenciájában, mind szerkezetében nagymértékben hasonlít a bakteriális szuperantigén, a staphylococcus enterotoxin B.
A vírus és az emberi T-sejtek közötti kölcsönhatást erősítheti egy ritka mutáció (D839Y/N/E), amely a SARS-CoV-2 egyik európai törzséből származik. Továbbá, a felületi régió egy sejtközi adhéziós molekula (ICAM) -szerű motívum kiválasztott maradványait tartalmazza, amely közös a 2003-as és a 2019-es járványok SARS-vírusaiban.
A receptor-kötő tartományon található neurotoxin jellegű szekvencia-mintázat szintén nagy hajlamot mutat a TCR-ek megkötésére. A felnőtt COVID-19 betegek TCR-repertoárjának elemzése azt mutatja, hogy a súlyos hiperinflammatorikus betegségben szenvedők TCR-torzulást mutatnak, ami összhangban van a szuperantigén aktivációval. Ezek az adatok arra utalnak, hogy a SARS-CoV-2 S szuperantigénként működhet, amely a MIS-C és a citokinvihar kialakulását váltja ki a felnőtt COVID-19 betegeknél, ami fontos következményekkel jár a terápiás megközelítések fejlesztésére.
A súlyos akut légzőszervi szindrómás koronavírus 2 (SARS-CoV-2), a COVID-19-et okozó vírus, a SARS-CoV-val és a közel-keleti légzőszervi szindrómás (MERS)-CoV-val szoros rokonságban álló béta-koronavírus (β-CoV) (1). A COVID-19 felnőtteknél súlyos szövetközi tüdőgyulladást okozhat, míg gyermekeknél a súlyos légúti manifesztációk ritkák (2⇓-4). Nemrégiben azonban gyermekekben fellépő multiszisztémás gyulladásos szindrómát (MIS-C) figyeltek meg olyan betegeknél, akik vagy pozitívak voltak a COVID-19-re (PCR vagy szerológia alapján), vagy epidemiológiai kapcsolatuk volt a COVID-19-hez (5⇓-7). Az Egyesült Királyságból származó kezdeti jelentések után (5) számos esetet jelentettek Európában (6, 7) és New Yorkban (Centers for Disease Control and Prevention). Ugyanakkor Kínából, Japánból és Dél-Koreából, amelyeket szintén súlyosan érintett a COVID-19 pandémia, nem jelentettek ilyen eseteket (Európai Betegségmegelőzési és Járványvédelmi Központ).
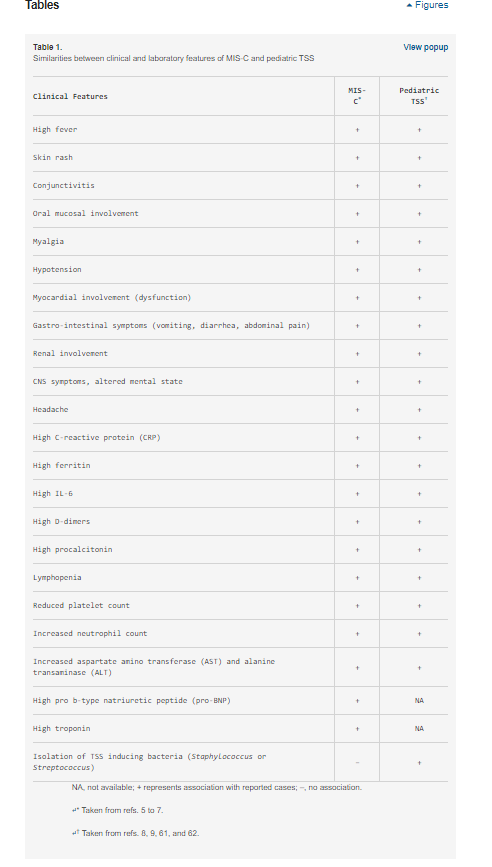
A MIS-C tartós lázzal és hiperinflammációval jelentkezik, több szervrendszer érintettségével, beleértve a szív-, gyomor-bélrendszeri (GI), vese-, hematológiai, bőrgyógyászati és neurológiai tüneteket (5⇓-7). Ezek a tünetek a markáns demográfiai, klinikai és laboratóriumi különbségek miatt inkább emlékeztetnek a toxikus sokk szindrómára (TSS) (8, 9) (1. táblázat), mint a Kawasaki-betegségre (KD) (6). Valóban, egy nemrégiben készült, nem kontrollált retrospektív esettanulmány arra a következtetésre jutott, hogy a MIS-C különbözik a KD-től és a KD-sokk szindrómától (10). A TSS-hez való hasonlóság és a MIS-C COVID-19-hez való társulása arra a feltételezésre vezetett bennünket, hogy a SARS-CoV-2 olyan szuperantigén fragmentumokkal rendelkezhet, amelyek gyulladásos kaszkádot indukálnak, és hozzájárulhatnak a súlyos felnőtt COVID-19 betegeknél megfigyelt hiperinflammációhoz és citokinviharhoz is (3, 4). Az általunk feltett kérdés az, hogy a SARS-CoV-2 tüske (S) rendelkezik-e olyan szuperantigén fragmentumokkal, amelyek a gazdasejtek citotoxikus adaptív immunválaszában részt vevő fehérjékhez kötődve ilyen reakciókat válthatnak ki? A 2003-as SARS-CoV-járványban (a továbbiakban SARS1) ilyen reakciót nem figyeltek meg.
Mi a SARS-CoV-2 sajátossága, és hogyan segíthették elő a SARS-CoV-2 S-ben a közelmúltban bekövetkezett mutációk a fokozott virulenciát?
A TSS-t kétféle szuperantigén (SAgs) okozhatja: bakteriális vagy vírusos. A bakteriális SAg-okat széles körben tanulmányozták. Ide tartoznak a Staphylococcus aureus és a Streptococcus pyogenes által szekretált fehérjék, amelyek gyulladásos citokinek és toxikus sokk tömeges termelését serkentik. Tipikus példák a TSS toxin 1, valamint a Staphylococcus enterotoxin B (SEB) és H (SEH). Ezek rendkívül erős T-sejtaktivátorok, amelyek képesek a II. osztályú fő hisztokompatibilitási komplex (MHC) molekulákhoz (MHCII) és/vagy a CD4+ és CD8+ T-sejtek T-sejtreceptoraihoz (TCR) kötődni. Az SAg-ok azon képessége, hogy megkerülik a TCR-ek antigénspecificitását, a T-sejtek széleskörű aktiválódását és citokinvihart eredményez, ami toxikus sokkhoz vezet (11, 12). Figyelemre méltó, hogy az SAg-ok nem kötődnek az MHCII fő (antigén) peptidkötő barázdájához, hanem más régiókhoz, valamint az αβTCR-ekhez kötődnek közvetlenül. Míg a korai vizsgálatok azt mutatták, hogy a bakteriális SAg-ok a dimer TCR-ek β-láncához kötődve aktiválják a T-sejteket azok változó doménjénél (V) (13⇓-15), újabb vizsgálatok kimutatták, hogy akár α-, akár β-lánchoz, akár mindkettőhöz kötődhetnek (16). A kérdés tehát az, hogy a SARS-CoV-2 S rendelkezik-e olyan szuperantigén fragmentumokkal/doménekkel, amelyek TCR-ekhez kötődhetnek?
Itt számítógépes modellezéssel határoztuk meg, hogy a SARS-CoV-2 S rendelkezik-e SAg-szerű fragmentumokkal és aktivitással. Kimutattuk, hogy a SARS-CoV-2 S-ben jelen van olyan többbázisú szakasz amely más SARS-szel rokon β-CoV-k S glikoproteinjéből hiányzik, nagy affinitású, nem specifikus kötődést közvetít a TCR-hez. Figyelemre méltó, hogy ennek a kizárólag a SARS-CoV-2-ben jelenlévő, ∼20 aminosavból álló mintázat szekvencia- és szerkezeti jellemzői nagymértékben hasonlítanak a toxin SEB jellemzőihez.
Elemzésünk továbbá azt is mutatja, hogy egy ritka SARS-CoV-2 S mutáció, amelyet egy európai törzsben észleltünk, potenciálisan fokozhatja a TCR-kötődést. Továbbá, a felnőtt COVID-19 betegek egy csoportjának elemzése feltárja, hogy a súlyos hiperinflammatorikus betegségben szenvedőknél a TCR-repertoár SAg-aktivitással összhangban lévő torzulása figyelhető meg. Ennélfogva ezek az eredmények fontos következményekkel járnak mind a MIS-C, mind a COVID-19 hiperinflammatorikus szindrómában szenvedő betegek kezelése és kezelése szempontjából.
Eredmények és összefoglalás
A SARS-CoV-2 tüske a TCR β-lánchoz kötődő nagy affinitású helyet tartalmaz, amely egy, a SARS2-re egyedülálló P681RRA684 szakaszt, inzertet tartalmaz.
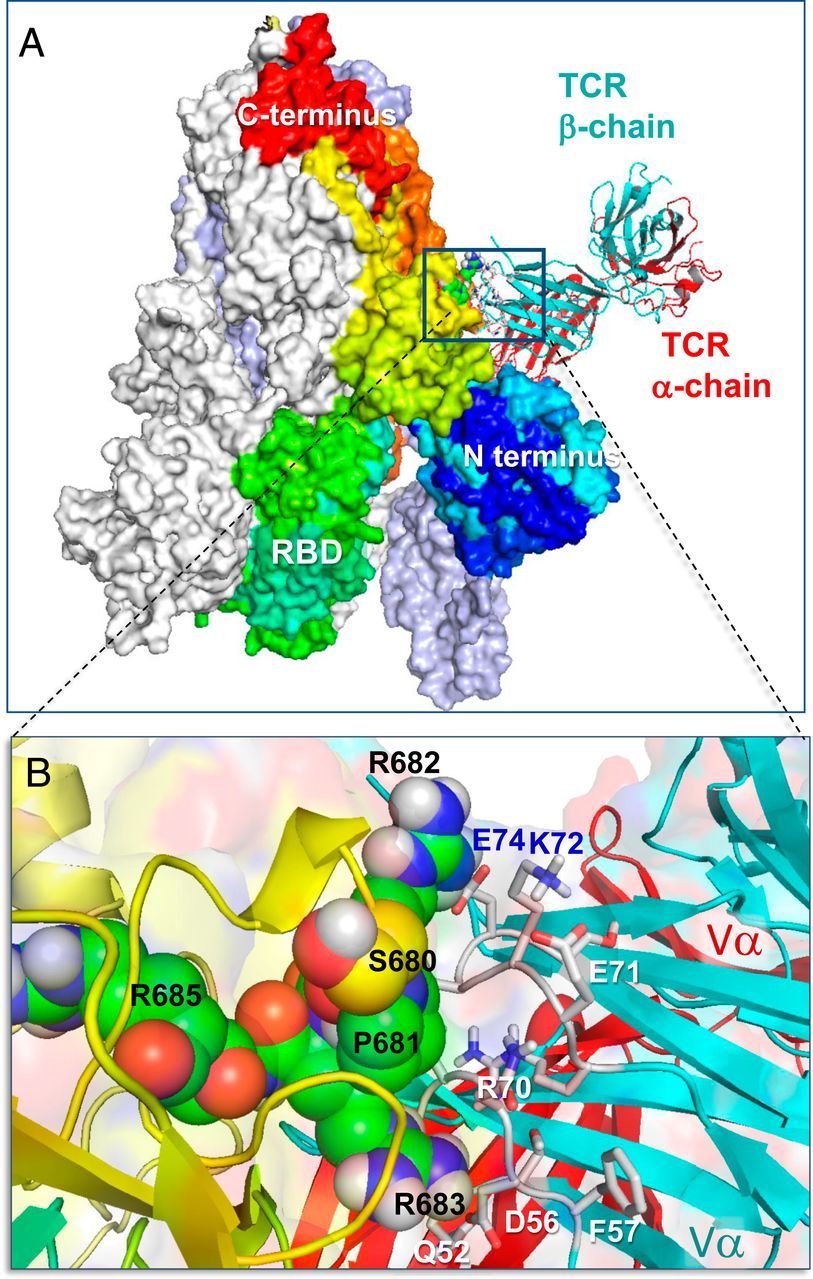
Először azt vizsgáltuk, hogy a SARS-CoV-2 S képes-e kötődni a TCR α- és/vagy β-lánchoz. E célból megalkottuk a SARS-CoV-2 S szerkezeti modelljét az S glikoproteinre felbontott krioelektronmikroszkópiás (krio-EM) szerkezet alapján (17). Ezt követően a SEH-val és MHCII-vel terner komplexben felbontott αβTCR röntgenszerkezetét (16) használtuk fel, hogy a ClusPro (18) segítségével egy sor szerkezeti modellt hozzunk létre a SARS-CoV-2 S-TCR komplex lehetséges kialakulására. Szimulációink két legvalószínűbb TCR-kötőhelyet találtunk az S minden egyes monomerjén: az egyik a receptor-kötő doménen (RBD; R319-K529 maradékok), a másik pedig az S1/S2 hasadási hely közelében az S1 és S2 alegységek között. Az előbbi közös volt a SARS1 és a MERS-CoV S-ben is, míg az utóbbi egyedi és erősen preferált volt a SARS-CoV-2 S-ben, amint azt részletesen az SI függelék S1 és S2 ábrái részletesen leírják. Ezért az 1A. ábrán bemutatott utóbbira összpontosítottunk, mint a legvalószínűbb komplexképzési mechanizmusra, amely megkülönbözteti a SARS-CoV-2 S-t a többi β-CoV-tól. Az S és a TCRVβ közötti határfelület közeli nézete (1B. ábra) erős interatomi kölcsönhatásokat mutat, amelyekben a tüskék S680-R683 maradékai, valamint a Vβ Q52, D56, R70-től E74-ig (CDR2) és S96-tól Q103-ig (CDR3) maradékai vesznek részt.
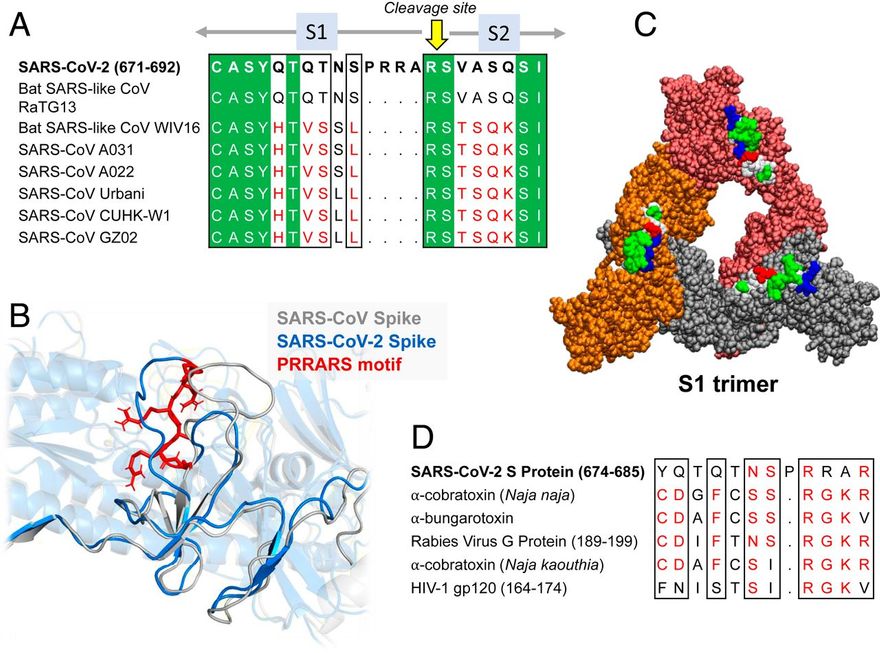
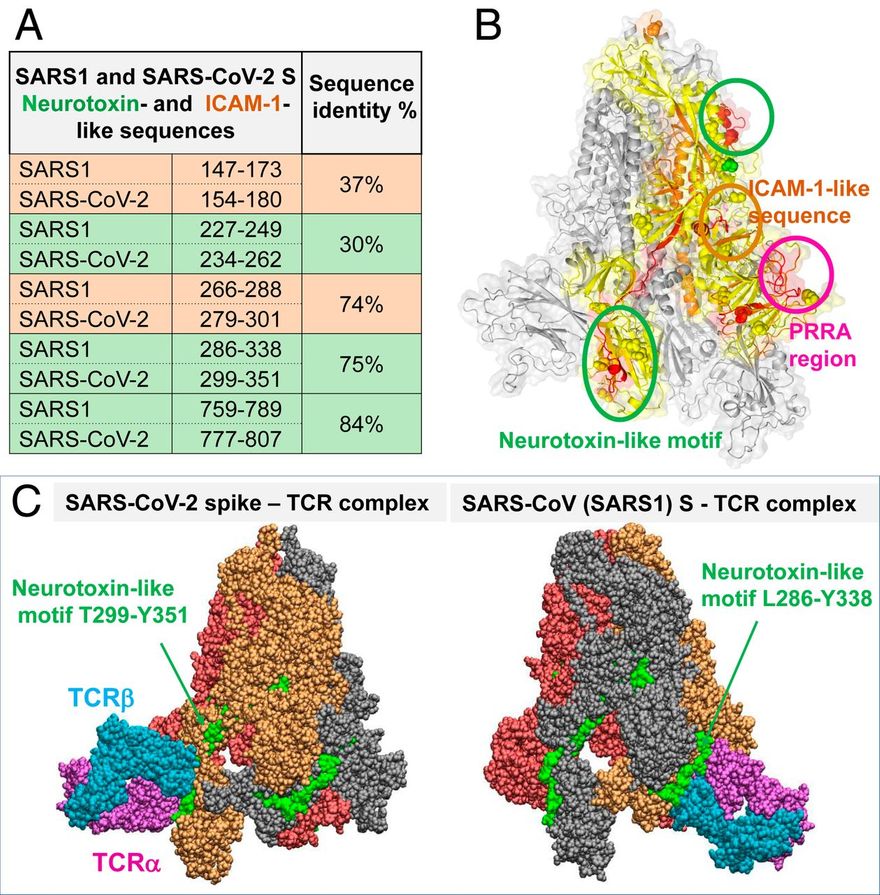
Megjegyezzük, hogy a SARS-CoV-2 S TCRVβ-kötő epitópjának középpontjában egy polibázisú szekvencia-motívum, a P681RRA684 (a továbbiakban PRRA) áll, és magában foglalja ennek a mintázatnak a szekvenciális és térbeli szomszédait. Más β-CoV S szekvenciákkal való összehasonlítás azt mutatja (19), hogy a SARS-CoV-2 S-t megkülönbözteti az S1/S2 hasadási helyet (R685-S686 peptidkötés) megelőző négyrezidős PRRA-beillesztés (2A ábra). A SARS1 és a SARS-CoV-2 S glikoproteinek szerkezeti összehasonlítása további szoros szerkezeti hasonlóságot mutat általánosságban [kivéve a specifikus határfelületi kölcsönhatásokban részt vevő RBD-iket (17)], de a két S glikoprotein jelentősen különbözik a SARS-CoV-2-re jellemző PRRARS-szakasz közelében, amely a külső felé nyitott (2B. ábra). Figyelemre méltó, hogy ennek a szakasznak és közeli szomszédjainak expozíciója tovább hangsúlyozódik az S1 trimerben (2C ábra), amely a humán proteázok (TMPRSS2 vagy furin) általi hasítás után vált le, hogy lehetővé tegye az S2 alegységek fúziós trimerének aktiválását.
A PRRA-közeli motívum további vizsgálata szoros szerkezeti hasonlóságot mutat a SEB szuperantigénnel, valamint szekvencia-hasonlóságot a neurotoxinokkal és egy vírus SAg-val.
Az inszerciós PRRA hét, egymás után következő maradékkal és az azt követő R685-tel együtt (a β-CoV-k között konzervált) egy Y674QTQTNSPRRAR685 motívumot alkot, amely homológ az Ophiophagus (kobra) és a Bungarus nemzetségekből származó neurotoxinok, valamint három RABV-törzs neurotoxinszerű régióival (20) (2D ábra). Megfigyeltük továbbá, hogy ugyanez a szegmens szoros hasonlóságot mutat a HIV-1 gp120 glikoprotein SAg-motívumának F164-V174 közötti F164-es motívumával. Ez a szoros szekvencia-hasonlóság mind a bakteriális, mind a vírusos SAg-motívumokkal, ami alátámasztja a SARS-CoV-2 S Y674-R685 szakaszának potenciális szuperantigén jellegét, arra késztetett minket, hogy tovább elemezzük a helyi szekvenciáját és szerkezetét.
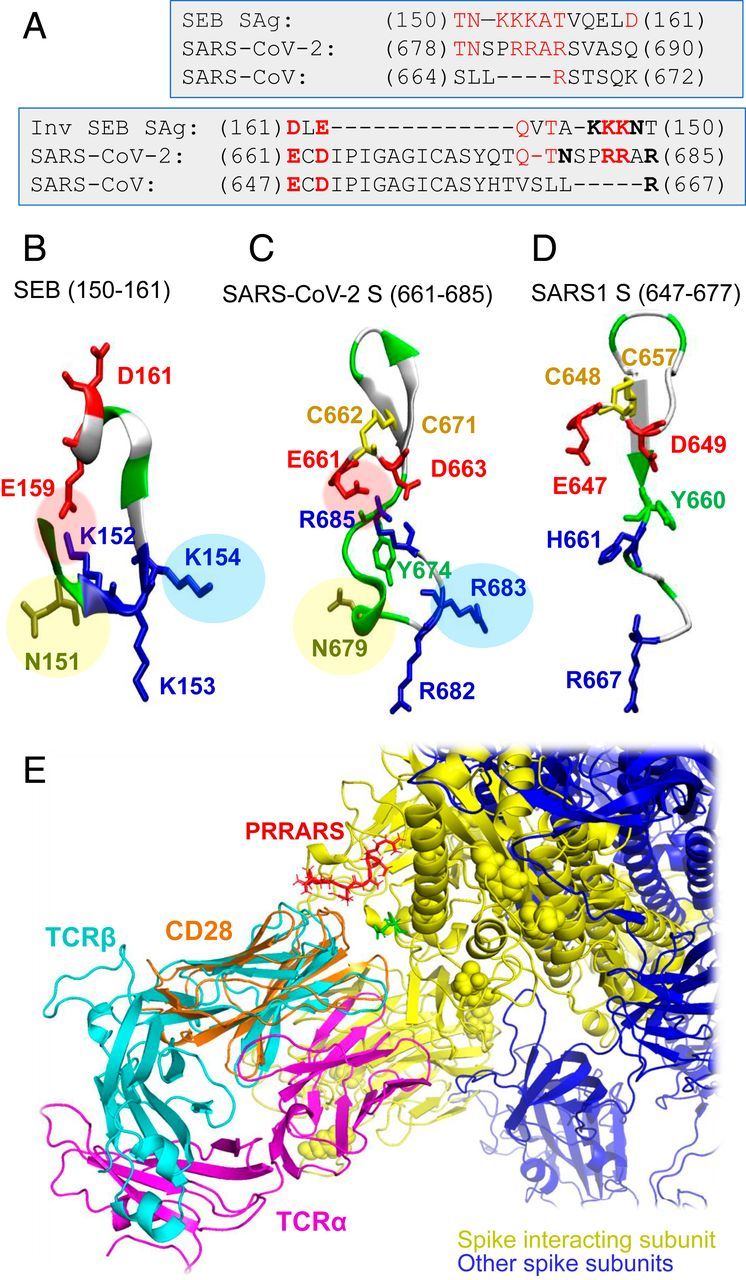
Elemzésünk érdekes szekvencia-hasonlóságot mutatott a SARS-CoV-2 S T678-tól Q690-ig terjedő fragmentuma és a SEB T150NKKKATVQELD161 szuperantigén peptidje között (3A ábra). Ez a dodekapeptid-szekvencia erős konzerváltságot mutat a staphylococcus és streptococcus SAg-ok széles skálája között (21, 22). Megjegyezzük, hogy a SARS1 szekvenciálisan illesztett szegmense (S664-től K672-ig) minimális hasonlóságot mutat a SEB SAg-gal (3. ábra A, balra). Ami még érdekesebb, hogy a SARS-Cov-2 motívum palindromikus viselkedést mutatott ehhez a szuperantigén SEB szekvenciához képest, abban az értelemben, hogy egy szélesebb szakasz, az E661-től R685-ig terjedő szakasz fordított irányban is igazítható a SAg peptidhez (3A ábra, jobbra). Ez felhívja a figyelmünket a SARS-CoV-2 S TCRVβ-kötőhely maradékainak sokoldalúságára és nagyfokú hajlamára, hogy potenciálisan SAg-szerű választ váltsanak ki.
Jelentős, hogy a SARS-CoV-2 S SAg-szerű szegmensének és a SEB peptidnek a szerkezete is figyelemre méltó hasonlóságot mutat (3. ábra B és C): Egy sóhíd (E159-K152 a SEB-ben és E661-R685 a SARS-CoV-2 S-ben) stabilizálja mindkét szerkezeti motívumot; három pozitív töltésű maradék (K152, K153 és K154 a SEB-ben és R682, R683 és R685 a SARS-CoV-2 S-ben) relatív orientációja megmarad; és egy aszparagin (N151 a SEB-ben, N679 a SARS-CoV-2-ben) egészíti ki a motívumot. Mindhárom jellemző hiányzik a SARS1 S-ből (3D ábra). Egy β-szál, amely nyilvánvalóan állványként szolgál, mindhárom tüskében konzerválódik, és megfigyelünk egy ciszteinpárt, amely potenciálisan diszulfidkötést képezhet a SARS-Cov-2 és a SARS1 tüskéiben (C662-C671, illetve C648-C657).
Ez az elemzés összességében azt jelzi, hogy a T678NSPRRAR685 szegmens potenciálisan egy feltételezhetően szuperantigén magot alkothat, amely következetesen megfelel a különböző bakteriális vagy vírus SAg-ok ellen (2C és 3. ábra A-C), a szomszédos aminosavak részvételével vagy anélkül. A 3. ábra A (jobbra), valamint a B és C ábrán látható kombinált szélesebb szekvencia- és szerkezetelemzés azonban egy még meggyőzőbb tulajdonságot tár fel: Ezt a feltételezett SAg magot szerkezetileg megszilárdítja egy olyan, tartósan savas szegmens, az E661CD663 térbeli közelsége, amely a SARS-CoV-2 S polibázisú PRRAR szegmensével egy rendkívül stabil sóhidat képez, hasonlóan a SEB-ben (de nem a SARS1 S-ben) megfigyelt sóhídhoz, amelyet egy, a SARS-CoV-2 S és a SEB (de nem a SARS1 S) között közös aszparagin egészít ki, és a SAg jelleget ez a fajta szerkezeti állványzat adhatja.
Megjegyezzük, hogy a SEB szuperantigén Y150NKKKATVQELD161 peptidje a CD28-hoz (21), a TCR-hez kötődik, amely a T-sejtek aktiválásához és túléléséhez szükséges kostimulációs jeleket szolgáltatja. A CD28 és a TCRV domének azonos (immunglobulin, Ig) hajtáson osztoznak (3E ábra), és az 1B ábrán bemutatott kötődési mechanizmus kisebb átrendeződésekkel alkalmazkodhat más Ig-hajtású molekulákkal, köztük semlegesítő antitestekkel való kölcsönhatásokhoz. A SEB CD28-hoz kötődő homológ szuperantigén szegmense miatt a SARS-CoV-2 tüskék E661-R685 maradékainak lehetséges kötődését is vizsgáltuk a CD28-hoz. Szimulációink azt mutatták, hogy ugyanez a szegmens ugyanúgy képes kötődni a CD28-hoz, ami tovább erősíti a fragmentum erős hajlamát a T-sejtek aktiválásának stimulálására.
Egy neurotoxinszerű fragmentum az RBD-nél szintén megkötheti az αβTCR-t, így tovább fokozza az immunválaszt.
A SARS-CoV-2 S szegmensek további vizsgálata, amelyek szekvenciálisan homológok a SARS1 S esetében azonosított neurotoxinszerű szekvenciákkal (23) (zöldre színezett sorok, 5A. ábra), két, a két CoV között konzervált motívumra mutatott rá: A SARS-CoV-2 S1 299-351-es maradékai részben átfednek az RBD-vel és az S2 777-807-es maradékai. A TCR-ek lehetséges kötődését kereső szimulációink ezekhez a neurotoxinszerű motívumokhoz azt mutatták, hogy a T299-től Y351-ig terjedő motívum (a PRRA régió után a második legnagyobb affinitású hely) és a SARS1-ben található megfelelője (az első legnagyobb affinitású hely) nagy hajlamot mutat a TCR-ek kötődésére. Az 5C. ábra ezeket a komplexeket szemlélteti.
Egy nemrégiben végzett vizsgálat (24) jelentős T-sejt-reaktivitást mutatott ki a SARS-CoV-2 S glikoprotein 66 epitópjával szemben olyan embereknél, akik nem voltak kitéve a vírusnak, ami felhívta a figyelmet a humán CoV-k (HCoV-k), például a közönséges nátha HCoV-OC43, HCoV-HKU1, HCoV-NL63 és HCoV-229E, amelyeknek hasonló a szekvenciájuk a SARS-CoV-2 genommal. A SARS-CoV-2 proteom 474 peptidjének szűrése során összesen 142 ilyen keresztreaktív epitópot azonosítottak (24).
Megvizsgáltuk, hogy az itt azonosított neurotoxinszerű régiók között vannak-e ezek a keresztreaktív epitópok. Figyelemre méltó, hogy a négy legelőkelőbb helyen álló epitóp közül (a T-sejt-reaktivitás alapján rangsorolva, foltképző sejtek [SFC]/106 PBMC alapján mérve) kettő (321-335 és 316-330 peptidek) a T299-Y351 neurotoxinszerű fragmentumhoz, egy (236-250 peptid) pedig a 234-262 fragmentumhoz tartozik. Valójában az előbbit teljesen átfedte nyolc, részben átfedő keresztreaktív epitóp, amint azt az SI Függelék S4. ábrája szemlélteti, ami arra utal, hogy ez a régió megkülönböztetett módon képes kiváltani a CD4+ T-sejtválaszt. Ezek a megfigyelések erőteljesen alátámasztják e motívum TCR-hez kötődő magas affinitását (5C. ábra).
Összességében ez a T299-től Y351-ig tartó neurotoxinszerű szekvencia figyelmet érdemel, mint a COVID-19 betegek központi idegrendszeri (CNS) rendellenességeinek lehetséges forrása.
A 66 epitóp közül megemlítjük a 661-675-öt, amely a SAg-szerű E661-R685 régióba esik (3. ábra), bár alacsony reaktivitással és gyakorisággal. A PRRA inzert hiánya a keresztreaktív epitópok között nem meglepő, mivel ez az inzert az összes SARS-szel kapcsolatos βCo-V között csak a SARS-CoV-2 S-re jellemző, és a keresztreaktivitás a szekvencia hasonlósággal nő azokkal az antigénekkel/peptidekkel, amelyeknek a donorok már ki voltak téve. A SARS-CoV-2 és a SARS1 közötti szekvenciaazonosság 40% a SAg-szerű régió 671-685 közötti részén, és a 33-40%-os szekvenciaazonossággal rendelkező keresztreaktív peptidek aránya a jelentések szerint 1% (24). Másrészt érdekes megjegyezni, hogy egy nemrégiben végzett tanulmány (25) szerint a súlyos COVID-19-et átélt lábadozó betegeknél erős T-sejt-reaktivitást mutató epitópok esetében a SAg régió PRRA-tartalmú részével átfedő epitóp (680-688) az egyik legnagyobb affinitású, HLA-hoz kötődő epitópnak bizonyult.
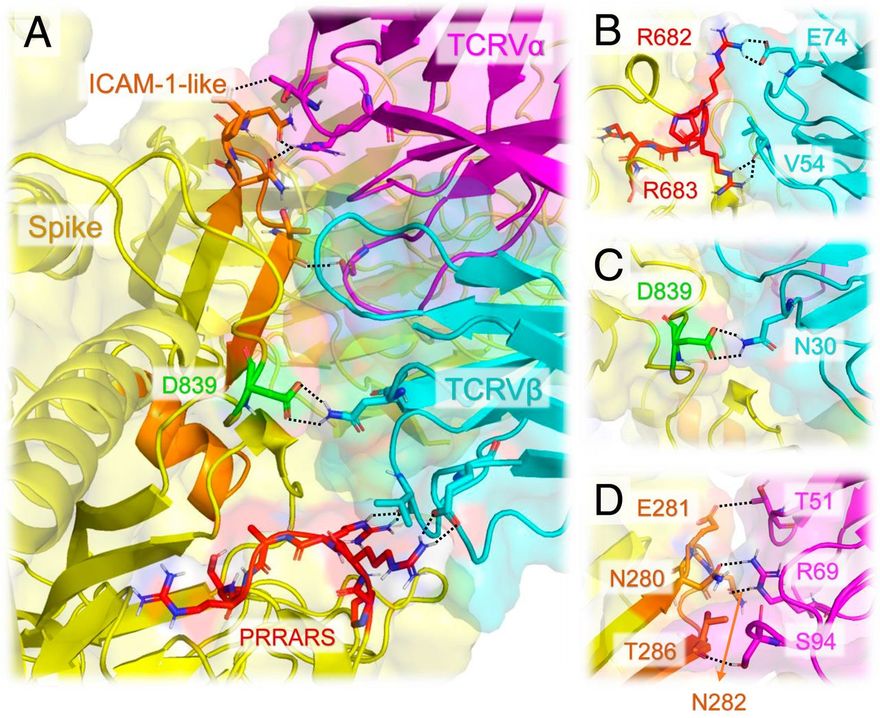
Egy európai SARS2-törzsben nemrégiben megfigyelt ritka mutáció, a D839Y/E hozzájárulhat a TCR-rel való kölcsönhatás stabilizálásához.
Érdekes módon a SARS-CoV-2 S-kötő régió három olyan maradékot tartalmaz, amelyekről nemrégiben jelentették, hogy mutálódtak az Európából és az Egyesült Államokból származó új törzsekben (26, 27): D614G, A831V és D839Y/N/E. Az előbbi kettő potenciálisan kölcsönhatásba léphet az MHCII-vel, a SARS-CoV-2 S, MHCII és TCR számára létrehozott terner modell alapján (SI függelék, S5 ábra), míg az utóbbi (D839) közel van a TCRVβ-hez és erősen kölcsönhatásba lép az N30-mal (4. ábra A és C és SI függelék, S6 ábra). A D839 tirozinnal való helyettesítése erősíti a tüske és a TCRVβ közötti kölcsönhatásokat. A D839Y mutánsban a határfelületi kölcsönhatásokat az Y839 és a D32 közötti hidrogénkötés, az Y839 és az N30 közötti aromás (poláris-π) kölcsönhatás, valamint a K73 és S97 közötti lehetséges elektrosztatikus kölcsönhatások stabilizálják. A tüske és a TCR közötti kötési affinitás változása a D839-nek tirozinná történő mutációjával ΔΔGD→Y = -0,9 ± 0,7 kcal/mol, ami a kötési affinitás körülbelül négyszeres növekedését jelzi, ha az aszparaginsavat tirozinnal helyettesítjük ebben a pozícióban. Ugyanez a minőségi hatás érvényes, de gyengébb mértékben, az aszparagin vagy glutaminsavra történő mutációknál. A módszer és az eredmények részleteit lásd az SI függelék S1. táblázatában.
A TCR-repertoár elemzése TCRVβ ferdülést és SAg-hatást jelző elágazási sokféleséget mutat súlyos és hiperinflammatorikus COVID-19-es betegeknél.
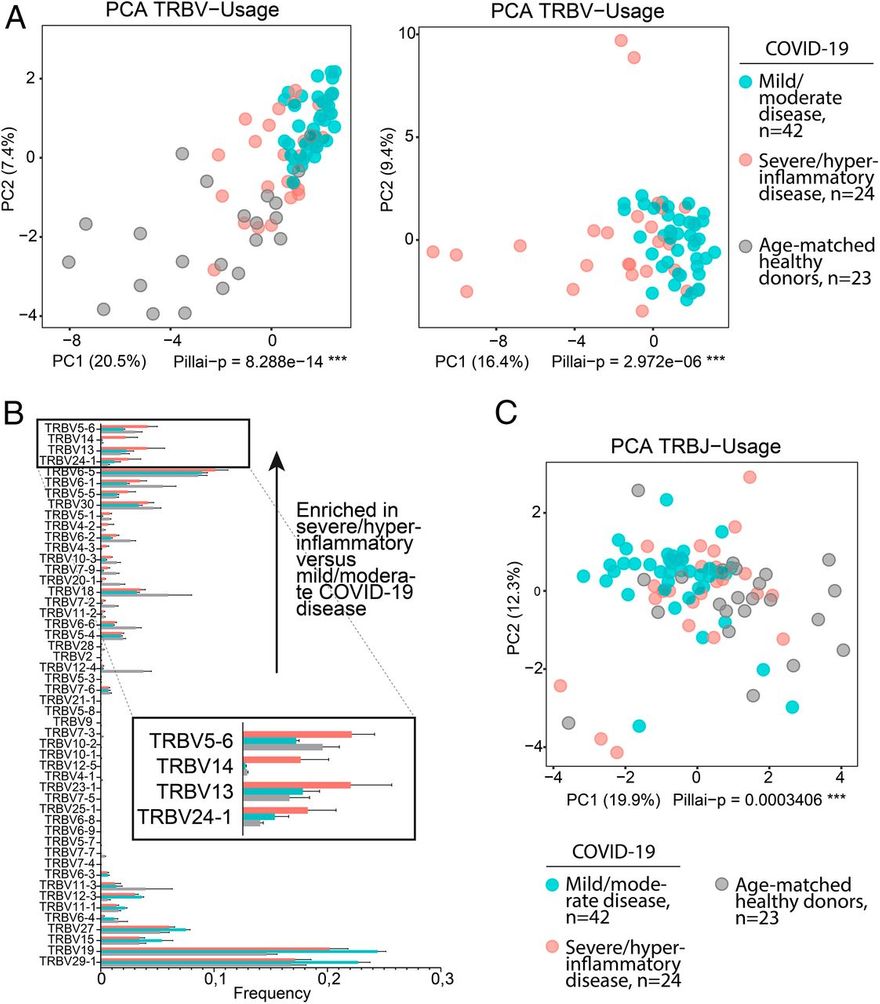
A SAg specifikus TCR Vβ láncokhoz való kötődése Vβ torzulást eredményez, így a specifikus Vβ láncokkal és változatos antigénspecificitással rendelkező T-sejtek dominálnak a TCR-repertoárban (11, 13). Ha a SARS-CoV-2 S-ben azonosított motívum SAg-ként működik, akkor azt feltételeztük, hogy az enyhe/közepes COVID-19 betegség lefolyásában és a hiperinflammáció nélküli felépülésben szenvedő betegeknél a SARS-CoV-2 epitópjait CDR3-mediált módon felismerő T-sejtek által közvetített adaptív immunválaszok jelentkeznek, míg a súlyos/hyperinflammatorikus COVID-19-ben szenvedő betegeknél legalább részleges SAg-felismeréssel összhangban lévő immunválaszok jelentkeznek. E célból elemeztük az újgenerációs szekvenálás (NGS) immunszekvenálási adatait 38 enyhe/közepes COVID-19-es beteg (42 minta) és 8 súlyos, hiperinflammatorikus COVID-19-es beteg (24 minta) esetében, amelyek egy korábban vizsgált csoport részét képezték (28). A két csoportnak megfelelő TCR β-lánc-változó gén (TRBV) repertoárjának főkomponens-elemzése (PCA) kimutatta, hogy az enyhe/közepes COVID-19 lefolyású betegek elkülönülnek a súlyos/hiperinflammatorikus COVID-19-es betegekétől (6A. ábra).
Az eltérő gének használatának elemzése azt mutatta, hogy számos TRBV gén felülreprezentált a súlyos/hiperinflammatorikus COVID-19 betegcsoportban (6B. ábra). Ezzel szemben a J gének eloszlásának PCA-ja sokkal kisebb torzulást mutatott, ami arra utal, hogy a V gének eloszlására szelektív nyomás gyakorolt preferenciális hatást (6C. ábra). A J-gének diverzitásának további vizsgálatához, kifejezetten a súlyos/hiperinflammatorikus COVID-19-es esetekben felülreprezentált V-gének tekintetében, kivontuk a TRBV5-6, TRBV13, TRBV14 és TRBV24-1 génekkel átrendeződött összes J-gént a súlyos/hiperinflammatorikus COVID-19-es betegek repertoárjából, és ezt összehasonlítottuk a korban illesztett egészséges donorokból kivont J-génekkel. Ez az elemzés nagyon változatos TRBJ géneloszlást mutatott, ami CDR3-diverzitást feltételez a megfelelő kiterjesztett átrendeződésekben (SI Függelék, S7. ábra).
Eredményeink együttesen azt sugallják, hogy a súlyos és hiperinflammatorikus COVID-19-es betegeknél a TCR-ek különböző V gének felhasználásával történő expanziója, valamint a J gén/CDR3 diverzitás jelenik meg ezekben az átrendeződésekben, ami összeegyeztethető egy SAg-szelekciós folyamattal.
A súlyos COVID-19 betegeknél aktivált TRBV-géneknek megfelelő TCR-ek képesek a SARS-CoV-2 S. SAg-szerű régiójához kötődni.
Végül olyan, szerkezetileg felbontott TCR-ek felé fordítottuk figyelmünket, amelyek a súlyos/hyperinflammatorikus COVID-19 betegeknél feldúsult TRBV5-6, TRBV13, TRBV14 és TRBV24-1 gének által kódolt Vβ-láncokat tartalmazzák. Megvizsgáltuk, hogy ezek a TCR-ek képesek-e a SARS-CoV-2 S SAg-szerű régiójának E661-R685-éig terjedő szakaszát az 1. ábrán látható TCR-hez hasonlóan megkötni. A Protein Data Bank (PDB) keresésünk során a TRBV5-6, TRBV14 és TRBV24-1 géneknek megfelelő αβTCR szerkezeteket találtunk, azaz olyan TCR-eket, amelyek Vβ-láncai 95-100%-ban megegyeznek e három gén fehérjetermékével. Amint az SI Függelék S8. ábráján látható, mindháromról igazolták, hogy nagy affinitással kötődik a SAg-szerű helyhez, és az 1. ábrán bemutatottakhoz nagyon hasonló kölcsönhatásokat fejtenek ki. Modelljeink és szimulációink az energetikailag kedvező terner komplexképződés lehetőségét is jelezték e TCR-ek, az MHCII és a tüske között. Összességében ezek a szimulációk azt mutatták, hogy ezek a súlyos/gyulladásos COVID-19 betegeknél feldúsult TCR-ek képesek a SARS-CoV-2 S-t annak SAg-szerű régiójában megkötni és terner komplexeket képezni az MHCII-vel.
Következtetés
A COVID-19 súlyos manifesztációihoz vezető immunpatológia megértése mind a felnőttek, mind a gyermekek esetében kritikus jelentőségű a betegség hatékony kezelése és kezelése szempontjából. A MIS-C figyelemre méltó hasonlóságot mutat a gyermekkori TSS-sel (5⇓⇓⇓⇓-9). In silico modellezés és elemzés segítségével megállapítottuk, hogy a SARS-CoV-2 egy szuperantigén-motívumot kódol az S1/S2 hasadási hely közelében. Ez a régió szekvenciájában és szerkezetében nagymértékben hasonlít a SEB SAg-motívumhoz, amely kölcsönhatásba lép mind a TCR-rel, mind a CD28-zal (21), és közvetíti a TSS-t. A SEB lehetővé teszi a T-sejtek nagymértékű aktiválódását és proliferációját (12), ami a proinflammatorikus citokinek, köztük az IFNγ, TNFα és IL-2 T-sejtekből, valamint az IL-1 és TNFα antigénprezentáló sejtekből történő tömeges termelését eredményezi (12). Ez a citokinvihar többszervi szövetkárosodáshoz vezet, mint amilyen most a MIS-C-ben megfigyelhető. Eredményeink arra utalnak, hogy a hiperinflammatorikus szindróma a SARS-CoV-2 S glikoprotein szuperantigén aktivitásából ered. Továbbá ezek az eredmények felvetik annak lehetőségét is, hogy a felnőtteknél a COVID-19 súlyos eseteiben megfigyelt hiperinflammációt szintén az S-fehérje SAg-szerű aktivitása okozhatja. A SAg-ok ugyanis hasonló gyulladásos citokin szignatúrát indukálnak, mint ami a COVID-19 súlyosságát és halálát jelzi előre, beleértve az IL-6, TNFα, IL-8 és IL-1β-t (12, 29). Továbbá a COVID-19 betegek T-sejtes immunválaszának elemzése azt mutatja, hogy a súlyosabb és hiperinflammatorikus klinikai lefolyású betegeknél a SAg-aktivitással összhangban lévő TCRVβ-ferdülés figyelhető meg.
Érdekes módon a SARS1 immunogenitásának alapos vizsgálata, amelyet egy 128 SARS1-ből felépült egyénekből álló kohorszon végeztek (30), azt mutatta, hogy a SARS1 tüske 18-mer D649-L666 (DIPIGAGICASYHTVSLL) a T-sejtek által leggyakrabban felismert peptidek közé tartozik a teljes SARS1 CoV proteomot átfogó, átvizsgált 1843 peptid közül [Li és munkatársai (30) 3. táblázata]. Ez a szegmens egybeesik a SARS1 S régió E647-től R667-ig terjedő szakaszával, amely szekvenciálisan (és szerkezetileg) homológ a mi SARS-CoV-2 tüskénk SAg-szerű motívumával E661-től R685-ig (3A ábra, alsó igazítás). Ez nagyon erősen alátámasztja a mi SAg-motívumunk T-sejt-stimuláló képességét, mivel 12/18 aminosavban osztozik a SARS1 18-merrel. A fennmaradó aminosavak (beleértve a SARS1 S-ben nem szereplő PRRA inszertet is) pedig még erősebb szuperantigén tulajdonságokkal ruháznák fel a SEB-töredékkel való szoros hasonlóságuk révén. Eredményeink felvetik annak izgalmas lehetőségét, hogy a TSS esetében alkalmazott immunmoduláló terápiás lehetőségek, beleértve az intravénás immunglobulint (IVIG) és a szteroidokat, a MIS-C esetében is hatékonyak lehetnek. A kezdeti publikált és nem publikált jelentések valóban arra utalnak, hogy a MIS-C betegek jól reagálnak az IVIG-re szteroidokkal vagy anélkül (5⇓-7). Az IVIG olyan antitesteket tartalmaz, amelyek semlegesítik a SEB-t (31). Tekintettel a SEB és a SARS-CoV-2 S-fehérje SAg-motívuma közötti szerkezeti hasonlóságokra, fennáll a lehetősége ezen immunglobinok keresztreaktivitásának, ami részben megmagyarázhatja a MIS-C esetek IVIG-re adott válaszát.
A SEB TSS modellekben tesztelt, az Élelmiszer- és Gyógyszerügyi Hivatal által jóváhagyott egyéb gyulladáscsökkentő gyógyszerek is hatásosak lehetnek, beleértve a CTLA4-Ig-et, amely képes gátolni a CD28 költségimulációt (32), és a rapamycin emlős célpontját (mTOR) gátló rapamycin (33), amelyet már alkalmaznak a COVID-19 esetében. Ezen túlmenően a humanizált monoklonális anti-SEB Abs (34, 35) potenciális terápiás előnyt jelenthet a MIS-C betegeknél. Figyelemre méltó, hogy a TSS egérmodelljében kimutatták, hogy a SEB szuperantigén kihívása a szuperantigén motívumának rövid peptid mimetikumával megelőzhető (21).
Érdekes lenne megvizsgálni, hogy a SARS-CoV-2 tüskés szuperantigén régiójának rövid peptid mimetikumai alkalmazhatók-e a gyulladásos citokin gének indukciójának és a toxikus sokknak a megelőzésére/csillapítására MIS-C betegeknél. Jelenleg a vizsgált COVID-19 antitestterápiák többségét úgy tervezték, hogy a SARS-CoV-2 tüske RBD-jét és néhányan az N-terminális doménjét (NTD) célozzák (36⇓⇓⇓⇓⇓⇓⇓-44).
Szimulációink azt is jelzik, hogy az RBD potenciálisan kölcsönhatásba léphet a TCR-ekkel. Vizsgálatunk azonban azt sugallja, hogy a tüske "szára", illetve annak SAg-szerű motívuma is célpontként szolgálhat. Az RBD-khez képest viszonylag kevesebb mutáció található a SARS-CoV-2 SAg régiójában; nevezetesen a PRRA inzert egyedülálló a SARS-CoV-2-ben, és minden eddig szekvenált izolátumában megmaradt (26, 27). Azt is fontos megjegyezni, hogy a SARS-CoV-2 S-fehérjéről közölt krio-EM szerkezetek többsége GSAS vagy GSGS szubsztitúciót tartalmaz az R682RAR685 helyen,
Wrapp és munkatársai eredeti munkáját követve (17). Ugyanezt a szegmenst vagy mutálták (42⇓⇓-45), vagy eltávolították (38⇓⇓⇓-41), hogy lehetővé tegyék a fehérje kifejeződését és/vagy felbontását, az antitest-, nanoszervezet- vagy Fab-kötött tüske krio-EM vizsgálataiban. A "mutáns tüske" tehát nélkülözi azt az egyedi jelleget, amelyet egyébként a P681RRA polibázisú inzert és a szomszédos R685S hasítóhely adna, és az R682RAR685 magas reaktivitása elkerülhette ezeket a vizsgálatokat. Konstruktív lehet olyan antitestek vagy gyógyszerek tervezése, amelyek ezt a SAg-régiót célozzák, hogy ne csak a SAg által kiváltott gyulladásos citokin génindukciót modulálják (12), hanem a vírus bejutásának lehetővé tételéhez nélkülözhetetlen hasítást is blokkolják (1, 19).
Alternatív megoldásként hasznosnak bizonyulhatnak a SAg-szerű régiót és az RBD-t egyaránt célzó kombinált terápiák. Szerencsére a COVID-19 súlyos légúti manifesztációi gyermekeknél, valamint a MIS-C kialakulása ritka. Ennek oka lehet a képzett immunitás (2). A T- és B-sejtek fontos szerepet játszanak a vírusellenes válaszban. A lábadozó COVID-19 betegek CD4+ és CD8+ T-sejtjei számos SARS-Cov-2 epitópot képesek felismerni, és az S-fehérje jelenti a fő célpontot. Érdekes módon a nem exponált egyének T-sejtjei is reagálnak a SARS-CoV-2 S-protein epitópjaira, ami alátámasztja a más koronavírustörzsekből származó keresztvírusos immunitás hipotézisét (24, 46).
Az azonban nem világos, hogy miért csak a fertőzött gyermekek töredékénél alakul ki MIS-C. Kimutattuk, hogy a SARS-CoV-2 egy európai törzsében talált D839Y mutáció fokozza a SAg-motívum TCR-hez való kötődési affinitását. Ez (legalábbis részben) megmagyarázhatja a MIS-C földrajzi eltolódását azokra a területekre, ahol az európai törzs endémiája van.
Az is lehetséges, hogy a vírusra adott gyenge kezdeti antitestválasz nem semlegesíti a SAg-t, ahogyan azt nemrégiben MIS-C betegeknél kimutatták (47), ami az immunerősödéshez vezet az ismételt expozíciót követően. Bizonyos HLA-típusok megengedőbbek az SAg megkötésére, és valóban kimutatták, hogy a HLA szerepet játszik a COVID-19 fogékonyságban (48).
Az Egyesült Királyságban eredetileg bejelentett kilenc eset közül hat afro-karibi származású volt, ami szintén a fogékonyság lehetséges genetikai összetevőjére utal (5). Ezenkívül a 12 év feletti egyének ∼80%-a rendelkezik anti-SEB antitestekkel (49, 50), amelyek védelmet nyújthatnak a SARS-CoV-2 S-fehérje SAg hatásaival szemben. A már meglévő anti-SEB antitestek prevalenciája szintén hozzájárulhat a súlyos COVID-19-es esetek kor szerinti megoszlásához felnőtteknél, mivel a védő SEB-titerek 70 éves kor után az idősebb felnőtteknél csökkennek.
Érdekes megjegyezni, hogy a MIS-C betegek körülbelül egyharmadánál vagy annál is kevesebb betegnél volt pozitív a SARS-CoV-2 teszt, de a többségnél (de nem mindegyiknél) szerológiai bizonyíték volt a fertőzésre vagy a COVID-19-nek való kitettségre (5-7). Ez arra utalhat, hogy a SARS-CoV-2 SAg késleltetett hiperinflammációs választ okoz bizonyos gyermekeknél. A SAg-ok az önreaktív T-sejtek kiváltása révén szerepet játszanak az autoimmunitásban (11).
Az ADE a vírus ismételt expozíciója után szintén hozzájárulhat a kontrollálatlan fertőzéshez és gyulladáshoz (51). Az is lehetséges, hogy a negatív nasopharyngealis PCR-teszt ellenére a vírus még mindig jelen van a GI-traktusban (52). A MIS-C betegek szokatlanul súlyos GI-tüneteket, hasi fájdalmat, hányást és hasmenést mutatnak, súlyos szívizomzavar és szívsokk mellett (5⇓-7), és az ilyen súlyos GI-tünetek gyakran társulnak a SAgs-re adott válaszhoz is (9). A SEB esetében egy specifikus fragmentum hasadása és felszabadulása felelős a GI-tünetek indukálásáért.
Azt, hogy az általunk felfedezett SARS-CoV-2 SAg-szerű struktúrát is hasonlóan lehet-e hasítani, és ez áll-e a MIS-C betegeknél megfigyelt GI-tünetek hátterében, még meg kell vizsgálni. Azt is megfigyeltük, hogy az RBD-vel részben átfedő neurotoxinszerű szegmens (T299-től Y351-ig) nagy affinitással kötődik a TCR-ekhez. Figyelemre méltó, hogy nemrégiben megfigyelték, hogy ez a régió erős és gyakori CD4+ T-sejtek által közvetített T-sejt-reaktivitást vált ki olyan donoroknál, akik nem voltak kitéve SARS-CoV-2 fertőzésnek (24).
Ez arra hívja fel a figyelmet, hogy képes potenciálisan neurotoxikus immunválaszt kiváltani olyan egyénekben, akik nem voltak kitéve olyan CoV-oknak, amelyek szekvenciálisan homológ peptideket tartalmaznak.
A továbbiakban fontos lesz megállapítani e régió jelentőségét a MIS-C-ben szenvedő gyermekeknél és felnőtteknél is gyakran jelentkező neurológiai rendellenességekben. Összefoglalva, öt fő megfigyelést tettünk: 1) a PRRAR és szekvenciális szomszédai kölcsönhatásba lépnek a TCRVβ CDR-jeivel, és ez a társulás nagyon hasonlít a SEB SAg TCRVβ-vel való társulásához; 2) a közeli D839 részt vesz ebben a kölcsönhatásban, és tirozinná történő mutációja erősítheti a TCRVβ-vel való társulást; 3) az ICAM-1-re jellemző szekvencia-motívum (N280-T286) kölcsönhatásba lép a TCRVα-val, tovább stabilizálva a tüske és a gazdasejt TCR közötti társulást; 4) egy neurotoxinszerű motívum (T299-tőlY351-ig) nagy hajlamot mutat a TCR-ekhez való kötődésre és potenciálisan neurotoxikus válaszok kiváltására, és ez utóbbi hatás mérséklődhet, ha a SARS-CoV-2-fertőzött egyén homológ szegmenseket tartalmazó HCoV-knek volt kitéve, amint azt egy nemrégiben végzett tanulmány (24) javasolta; és 5) a súlyos/hiperinflammatorikus COVID-19-ben szenvedő felnőtt betegek ferde TCR Vβ-repertoárt mutatnak, ami megkülönbözteti őket az enyhe/közepes COVID-19-ben szenvedő betegektől.
Összességében mind a számítási modellezésből, mind a TCRB-k NGS immunoszekvenálásából származó, humán minták elemzéséből származó eredményeink azt jelzik, hogy a SEB-mediált TSS kezelésére használt stratégiák vagy az S-fehérje és a TCR-ek kölcsönhatásának blokkolására irányuló megközelítések segíthetnek csökkenteni a COVID-19 hiperinflammatorikus manifesztációit vagy (neuro)toxikus hatásait felnőttek és gyermekek esetében egyaránt.
A TCR kötődése a SARS-CoV-2 spike trimerhez a "PRRA" inzert közelében. (A) A komplex és a határfelületi kölcsönhatások összképe és (B) közelképek. Az A-ban a spike monomerek fehér, jégkék/szürke, és spektrálisan a kéktől (N-terminális domén) a vörösig színezettek, mindezek felületi ábrázolásban láthatóak. A spektrálisan színezett monomer, amely a TCR-t is megköti, N- és C-terminálisa és RBD-je fel van címkézve; a jobb szemléltetés érdekében az S trimer úgy van orientálva, hogy az RBD-je alul van. A TCR α- és β-láncok piros és ciánkék szalaggal vannak jelölve. B-ben az S680PPRAR685 szegmens, beleértve a PRRA inszertet és az erősen konzervált R685 hasítóhelyet, van der Waals ábrázolásban látható (fekete címkék); a TCR Vβ doménjének közeli CDR maradékai kék/fehér színnel vannak jelölve. Lásd a további információkat az SI függelék S1. ábráján.
Megjegyezzük, hogy a SARS-CoV-2 S TCRVβ-kötő epitópjának középpontjában egy polibázisú szekvencia-motívum, a P681RRA684 (a továbbiakban PRRA) áll, és magában foglalja ennek a motívumnak a szekvenciális és térbeli szomszédait. Más β-CoV S szekvenciákkal való összehasonlítás azt mutatja (19), hogy a SARS-CoV-2 S-t megkülönbözteti az S1/S2 hasadási helyet (R685-S686 peptidkötés) megelőző négyrezidős PRRA-beillesztés (2A ábra). A SARS1 és a SARS-CoV-2 S glikoproteinek szerkezeti összehasonlítása tovább mutatja a szoros szerkezeti hasonlóságot általánosságban [kivéve a specifikus határfelületi kölcsönhatásokban részt vevő RBD-iket (17)], de a két S glikoprotein jelentősen különbözik a SARS-CoV-2-re jellemző PRRARS motívum közelében, amely a külvilág felé exponált (2B. ábra). Figyelemre méltó, hogy ennek a motívumnak és közeli szomszédjainak expozíciója tovább hangsúlyozódik az S1 trimerben (2C ábra), amely a humán proteázok (TMPRSS2 vagy furin) általi hasítás után vált le, hogy lehetővé tegye az S2 alegységek fúziós trimerének aktiválását.
A PRRA inzert szekvenciája és szerkezeti tulajdonságai. (A és B) A SARS-CoV-2 egy hasítóhelyet és SAg-szerű motívumokat (20) is kódol az inszerciós PRRA közelében, ami megkülönbözteti az összes SARS-szel rokon β-CoV-tól. (A) A SARS-CoV-2 és több SARS-szel kapcsolatos törzs (1) szekvenciaillesztése az inszerciós PRRA közelében. (B) A SARS-CoV-2 és a SARS1 szerkezeti összehangolása ugyanabban a régióban. A PRRARS motívumot piros pálcikák mutatják. (C) SARS-CoV-2 S trimer, amely csak S1 alegységekből áll. A protomerek narancssárga, piros és szürke színnel vannak jelölve, és van der Waals formátumban ábrázolva. A kiálló E661-R685 motívumok hidrofób, hidrofil, savas és bázikus maradékai fehér, zöld, piros és kék színnel vannak jelölve. (D) Szekvencia-hasonlóság a PRRA inzert közeli szomszédsága, a korábban közölt neurotoxin-motívumok (20) és a HIV-1 gp120 szuperantigén motívum (63) között az utolsó sorban.
A PRRA inzert szekvenciája és szerkezeti tulajdonságai. (A és B) A SARS-CoV-2 egy hasítóhelyet és SAg-szerű motívumokat (20) is kódol az inszerciós PRRA közelében, ami megkülönbözteti az összes SARS-szel rokon β-CoV-tól. (A) A SARS-CoV-2 és több SARS-szel kapcsolatos törzs (1) szekvenciaillesztése az inszerciós PRRA közelében. (B) A SARS-CoV-2 és a SARS1 szerkezeti összehangolása ugyanabban a régióban. A PRRARS motívumot piros pálcikák mutatják. (C) SARS-CoV-2 S trimer, amely csak S1 alegységekből áll. A protomerek narancssárga, piros és szürke színnel vannak jelölve, és van der Waals formátumban ábrázolva. A kiálló E661-R685 motívumok hidrofób, hidrofil, savas és bázikus maradékai fehér, zöld, piros és kék színnel vannak jelölve. (D) Szekvencia-hasonlóság a PRRA inzert közeli szomszédsága, a korábban közölt neurotoxin-motívumok (20) és a HIV-1 gp120 szuperantigén motívum (63) között az utolsó sorban.
A SARS-CoV-2 tüske és az αβTCR közötti határfelületi kölcsönhatásokat tovább stabilizálja egy ICAM-1-szerű motívum és a TCRVα domén közötti asszociáció. (A) A SARS-CoV-2 tüske és a TCR változó domének közötti interfész. A tüske sárgával, a TCR Vα és Vβ magenta, illetve ciánkék színnel látható. A PRRARS inzert piros színnel van kiemelve; a közelmúltbeli tanulmányban (26) azonosított D839 mutációs hely zöld színnel; a SARS-CoV-2 SARS1 tüskénél azonosított ICAM-1 (CD54)-szerű motívum SARS-CoV-2 megfelelője (23) narancssárga színnel. A szoros határfelületi kontaktusokban részt vevő rezidensek pálcikákkal vannak jelölve, a nitrogén- és oxigénatomokat kékkel, illetve pirossal színezve. A 2,5 Å-nál kisebb távolságban lévő atompárok közötti kölcsönhatásokat fekete szaggatott vonalak jelzik. (B) Közelkép a PRRARS inzert/motívum és a TCR Vβ közötti kölcsönhatásokról. (C) Ugyanez a D839 mutációs hely esetében. (D) Az ICAM-1-szerű motívum (narancssárgával jelölve) és a TCRVα CDR-ek kiválasztott maradékai közötti kölcsönhatások.
Neurotoxinszerű szekvenciák a SARS-CoV-2 S RBD-ben és TCR-kötő képességük. (A) A SARS1 és a SARS-CoV-2 tüskéi esetében azonosított bioaktív, neurotoxinszerű (zöld) és ICAM-1-szerű (narancssárga) szegmensek összehasonlítása. (B) A két CoV között konzervált két neurotoxinszerű régió (zöld körökbe zárva) és egy ICAM-1 régió (narancssárga kör; lásd a 4. ábrát) locijai, amelyek a SARS-CoV-2 S egy monomerjén (sárgával kiemelve) láthatók. (C) A TCR kötőpózai a SARS-CoV-2 (balra) és SARS1 (jobbra) S fehérjéken, amelyek a jelzett konzervált neurotoxin-motívummal létesítenek kapcsolatot.
A TRBV-használat elferdülése a súlyos/hiperinflammatorikus COVID-19 betegeknél; 24 súlyos/hiperinflammatorikus COVID-19 eset repertoárját elemeztük az enyhe/közepes COVID-19 esetek 42 repertoárjával szemben, 23 korban illeszkedő egészséges donor repertoárjával együtt és anélkül (a súlyos/hiperinflammatorikus COVID-19 csoporthoz életkor szerint illeszkedő). (A) A TRBV-használat PCA-ja. Az 1. és 2. főkomponensek láthatóak; a tengelyek hozzájárulásának százalékos aránya zárójelben szerepel. A statisztikai elemzést többváltozós varianciaanalízis (MANOVA) Pillai-Bartlett-teszttel végeztük. (B) TRBV-használat. Az egyes TRBV-gének repertoáronkénti aránya átlag ± SEM értékben van feltüntetve. A TRBV-gének a súlyos/hyperinflammatorikus versus enyhe/közepes COVID-19 betegségben feldúsult frakciókba vannak sorolva, alulról felfelé növekvő sorrendben. A súlyos/hyperinflammatorikus COVID-19 betegeknél feldúsult TRBV-k (TRBV5-6, TRBV14, TRBV13 és TRBV24-1) a mellékleten nagyítva láthatóak. (C) A TRBJ-használat PCA-ja az A. pontban leírtak szerint. Lásd még SI függelék, S7 ábra.